大家好,今天我们来认识碳元素,碳是对生物最基础最重要的元素,因此内容比较多,我总共查询了近百篇文献才写完这个专栏,希望大家喜欢,还请多多支持。
碳是原子序数为6的化学元素,元素符号为C。它是一种非金属,位于元素周期表第14族。碳是少数几个自远古就被发现的元素之一。碳可以形成大量化合物,其数量比任何其他元素都多,迄今为止已有近千万种化合物,然而,这个数字只占标准条件下理论上可能的化合物数量的一小部分。因此,碳被称为元素之王。
一、特性
在标准大气压下,碳没有熔点,因为它的三相点为4600±300K及10.8±0.2MPa,并在约3900K左右升华。碳可以在高于高熔点金属(如钨或铼)的温度下保持固态。石墨在标准条件下比金刚**具反应性,尽管在热力学上更稳定,但它的离域π键更容易受到破坏。如,石墨可以通过热浓硝酸被氧化成苯六甲酸,同时会保留六方单位的结构,但破整体大结构会受到破坏。石墨也可以与氟气反应,最终得到一氟化碳,也称氟化聚合碳,提高温度最终可以生成碳氟比为1:1.12的化合物,富勒烯也可以与氟气以相似的方式发生反应,生成氟碳比最高为C₆₀F₄₈的化合物。合成一氟化碳的一个前体是氟石墨间层化合物。其他氟与石墨形成的层间化合物还有,聚(氟化二碳)((C₂F)n)、氟化四碳。氟化石墨是通过液相剥离技术制备单层氟化石墨的前体。
碳存在4个价电子。碳第一到第四电离能1086.5,2352.6,4620.5和6222.7kJ/mol远远高于其他的14族元素。碳的电负性为2.5,也明显高于其他14族元素(1.8-1.9),与第三和第四周期的某些非金属相似。碳碳单/双/三键半径为77.2pm,66.7pm和60.3pm。通常,配位数越低和键序越高则共价半径会随之降低。
碳所有生命的基础,并通过碳-氮循环将一些能量转化。虽然碳存在大量化合物,但大多数的碳在正常条件下不起反应。在标准温度和压力下,碳不与硫酸,盐酸,氯或任何碱反应。碳在室温下是较弱的还原剂。在更高的温度下,碳与氧气反应形成碳氧化物并会从某些金属氧化物中夺取氧气,留下金属单质。碳在高温下与一些金属结合形成金属碳化物,例如钢在高温下会产生碳化钨以及碳化三铁渗碳体。
1.碳的同素异形体
碳由于其电子排布能够形成许多同素异形体。近几十年来,已经研究并发现了更多的碳同素异形体。碳可形成大分子碳纳米结构。根据SACADA(萨马拉碳同素异形体数据库)统计,目前大约有500种假设的碳同素异形体。以下是简单的介绍。
①钻石
钻石是最常见的碳同素异形体之一,其中碳原子采用sp³杂化。钻石是已知最硬的天然矿物,除了另一颗钻石外,没有已知的天然物质可以切割钻石。
工业钻石与宝石级钻石的用途大不相同。工业钻石的价值主要在硬度和导热性,80%的开采钻石不适合用作宝石,这些会被称为圆粒金刚石,主要用于工业用途。除了开采钻石,合成钻石在发明后几乎立即应用于工业;平均每年会生产的合成钻石几乎开采的天然钻石质量的四倍。
钻石的主要用途是切割,钻孔,磨削和抛光。在这些技术中大多数钻石的使用都不需要有着很大质量。专业的应用包括在实验室中用作高压实验的容器以及高性能轴承等方面。
人造金刚石使得许多潜在应用变得可行。许多半导体微芯片及散热器已经开始使用金刚石。人造金刚石制造商也改进生产技术来提高生产量。
金刚石中的每个碳原子与其他四个碳原子以共价键结合。这些四面体在椅式结构中一起形成类似环己烷的六元碳环三维网络,这使得金刚石十分稳定。虽然在标况下,石墨是最稳定的碳单质,但新的研究表明,在接近0K,0Pa时,钻石比石墨更稳定。
②石墨类
Ⅰ:石墨
石墨也是碳最常见的同素异形体之一,碳原子采取sp²杂化。在标准条件下,石墨是最稳定的碳同素异形体。因此,它在热化学中用作定义碳化合物形的成热状态。
在石墨中,每个碳原子仅使用3个外层电子与平面中的其他三个碳原子形成共价键。而每个碳原子的另一个电子会形成离域的π键。离域电子可以在整个平面内自由移动。因此,石墨可以导电。然而,电子仅能沿着层平面传导。而在金刚石中,每个碳原子的所有四个电子会用于共价键的形成,这使得电子的运动受到限制,金刚石无法传导电流。
石墨粉可在工业上用于润滑。以前主要认为这是由于结构中片层之间松散耦合导致的,但在真空环境中,石墨是很差的润滑剂。因此后来的研究发现石墨的润滑性是由于石墨的层间结构可以吸附空气和水,这与其他层状润滑剂如二硫化钼的原理不同。最近的研究表明,超润滑可解释石墨这种特性。
当石墨出现大量结晶缺陷将层间平面结合在一起时,石墨会失去润滑性能变成所谓的热解碳。热解碳可当作植体填充物。
高温下的石墨不易燃烧。因此,石墨用于核反应堆和高温坩埚熔炼金属。在大约2000°C和5GPa下,石墨可转化为金刚石。
由于石墨的脆性和各向异性等机械特性,石墨通常会使用非纯净形式用作结构材料。
各向同性的热解石墨和碳纤维石墨坚固耐热,可用于导弹前锥,固体火箭发动机,高温反应器和电动马达刷。
石墨也可用于防火以及密封。在发生火灾时,石墨会膨胀以抵抗火焰渗透并防止烟雾扩散。石墨的起始膨胀温度介于150-300°C之间。此外,石墨的密度仅为2.3g/cm³,它比钻**轻。
石墨比金刚**具活性。这是因为反应物能够渗透到石墨中的六方碳原子层之间。但它一般不受普通溶剂,稀酸或熔融碱的影响。然而,铬酸将其氧化成二氧化碳。
Ⅱ:石墨烯
单层石墨被称为石墨烯,其中碳原子采用sp²杂化,它具有非凡的导电性及导热性等物理特性。它可以通过在绝缘层隙或导电基底上将石墨进行重复的机械剥离来制备。石墨烯可用于替换高性能电子设备中的单晶硅。另外,将石墨烯堆叠至两层,还可获得其他特殊性质。
Ⅲ:石墨苯烯
石墨苯烯是一种单层类石墨材料,其中碳原子采用sp²杂化。石墨苯烯具有以联苯烯作为结构基础的六方晶格,它也被称为联苯烯碳。
Ⅳ:AA'石墨(也被称为不对称石墨或无序石墨)
AA'石墨也是一种类似石墨的碳同素异形体,其中碳原子采用sp²杂化,但同与石墨中的有序片层结构相比,AA'石墨中这些层的位置彼此不同。
③无定形碳
无定形碳指的是那些不具有晶体结构的碳单质。与玻璃一样,无定形碳可以观察到一些小规模的有序结构,其中碳原子采用sp³和sp²的混合杂化方式,但没有整体固定的排列方式。大多数无定形碳实际上可能含有少量类似石墨或金刚石的微观结构。常见的无定形碳有活性炭、炭黑、碳纤维、焦炭等等。
煤碳和木炭也被非正式地称为无定形碳。然而,它们是煤和木材隔绝空气的热解产物,在正常条件下热解并不会产生真正的无定形碳。
④纳米碳
Ⅰ:富勒烯
富勒烯是一种完全由碳组成的中空分子,形状呈球型、椭球型、柱型或管状。富勒中的碳属于sp²杂化,其在结构上与石墨很相似,富勒烯是由六元环或五元环甚至七元环等组成的立体分子结构。由于这些分子与建筑学家巴克明斯特·富勒的建筑作品很相似,便将这些分子命名为富勒烯。自然界也存在极少量的富勒烯分子,太空望远镜发现在外太空中也有富勒烯的存在。
富勒烯独特的化学和物理性质以及在技术方面潜在的应用,引起了科学家们强烈的兴趣,尤其是在材料科学、电子学和纳米技术方面。富勒烯的化学和物理性质仍在大量研究实验室中进行。富勒烯也可能有潜在药用作用,将特异性抗生素与富勒烯的结构结合可以靶向对抗细菌,甚至能针对某些癌细胞如黑色素瘤。
常见的富勒烯可分为以下几类:
巴基球团簇:包括低碳富勒烯(碳原子数少于60个的富勒烯)、C₆₀(巴克明斯特富勒烯)、C₇₀、高碳富勒烯(碳原子数少于70个的富勒烯)
碳纳米管:非常小的中空圆柱形碳分子,有单壁和多壁之分;在电子工业有潜在的应用
巨碳管:比碳纳米管更大的碳分子,管壁可根据需要制备成不同厚度,在转运不同大小的分子方面具有一定的潜在价值
富勒烯聚合物:在高温高压下形成的链状、二维或三维聚合物,使用原子转移自由基加成聚合法可定向形成单链聚合物
纳米“洋葱”:由多壁碳层包裹在巴基球外部形成球状颗粒,可用于润滑剂
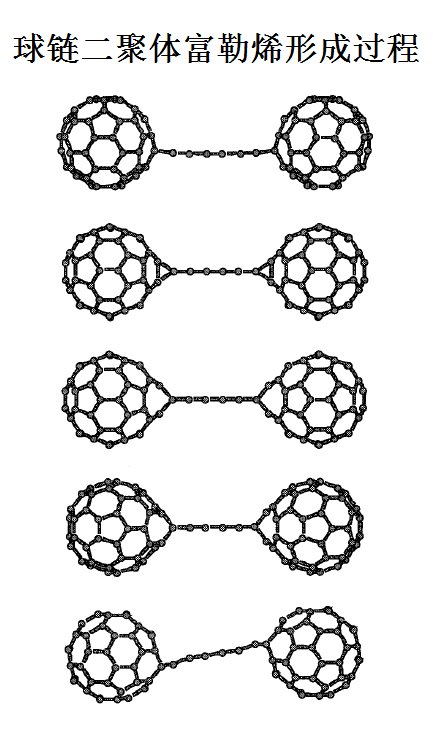
球链二聚体富勒烯:两个巴基球被碳链相连组成的单壁富勒烯环状加成物,有着良好的物理特性
富勒烯环:由大量对称的巴基球连接形成的环状结构。其稳定性受到分子间的五边形双键数影响
富勒体:泛指固态化的富勒烯及其相关化合物。而经过高压高温得到的富勒体会被称为超硬富勒体,在这种条件下普通的富勒烯固体会形成钻石形式的纳米晶体,它有相当高的机械强度和硬度。
Ⅱ:碳纳米管
碳纳米管,也称巴基管,是具有新特性的圆柱形碳分子,其中碳原子为sp²杂化。碳纳米管在纳米电子学、光学、材料学都表现出很好的应用前景,其具有非凡的强度,独特的电气特性,并且是高效的导热体。目前无机纳米管也已被合成出来。碳纳米管严格来说是富勒烯结构家族的成员。碳纳米管是圆柱形的,它的名称来源于其尺寸,因为纳米管的直径大约为几纳米,而它们的长度可达几厘米。有两种主要类型的纳米管:单壁纳米管和多壁纳米管。
Ⅲ:碳纳米芽
碳纳米芽是新发现的碳的同素异形体,是将芽状的富勒烯以共价键连接到碳纳米管的外侧壁,其中碳原子为sp²杂化。该杂化材料同时具有富勒烯和碳纳米管的性质。碳纳米芽预计可以当作非常好的场发射器。
Ⅳ:碳纳米卷
碳纳米卷的结构类似于多壁碳纳米管,但碳纳米卷的末端开口边缘具有螺旋状几何卷起,其中碳原子为sp²杂化。
目前已经有许多方法来生产碳纳米卷,包括电弧放电,球磨法和嵌入法等等。楔形基底机械剥离据报道也在实验上了类似的碳纳米卷。然而,由于纳米级晶体胶体制品加工困难,其实际应用受到限制。从热力学角度讲,碳纳米卷的表面通过范德华力进行相互堆叠以降低能量势垒。为了克服这一问题并获得高质量的纳米晶,最近已经开始使用聚合物辅助液体剥离技术,这种技术允许制造高吞吐量和高质量的纳米卷分散体。其他材料的纳米卷,如金纳米晶,也通过剥离技术成功制得。
Ⅴ:碳纳米带
碳纳米带,也称石墨烯纳米带或纳米石墨带,是宽度小于50nm的石墨烯条,其中碳原子为sp²杂化。其理论模型用于检查石墨烯边缘的纳米级尺寸效应。
碳纳米带的结构使其具有高电导率、高热导率、低噪声,这些优良品质促使碳纳米带成为集成电路互连材料的另一种潜在选择,其有可能替代铜金属。有些研究者试着用碳纳米带来制成量子点,在某些特定位置改变宽度会形成量子禁闭。此外,碳纳米带的低维结构使其具有非常理想的光电性能。碳纳米带放在微腔或纳米腔体中可充当激光器和放大器。新研究表明碳纳米带可应用于光通信系统。
Ⅵ:聚合钻石纳米棒
聚合钻石纳米棒,又称钻石纳米棒聚合体,是一种纳米级晶型钻石,也称纳米钻石或超钻石,其中的碳原子一般采用sp³杂化。聚合钻石纳米棒最早是于2003年由石墨的压缩制得的,它比一般的钻石要还要硬很多。后来,科学家通过压缩富勒体粉末也制得了聚合钻石纳米棒。
Ⅶ:施瓦茨碳
施瓦茨碳是一种有着负曲率的碳分子。由于其独特的性质,可用于电池内并用作催化剂。施瓦茨碳是研究人员在研究沸石模板碳时偶然制造的,研究人员在沸石内部注入含碳分子的蒸气,使得碳附着在沸石孔壁上并组装成类二维石墨烯片。由于比表面吉布斯自由能趋于最小,二维石墨烯片表面被拉紧以达到表面积最小化,形成类似于马鞍状的负曲率表面。最终成功获得了三种新型的碳结构分子。
基于理论研究,施瓦茨碳的碳笼表面会携带大量的电荷,这使得其成为性能出色的超级电容器材料;而较大的表面积比可使其用于催化石油和天然气工业中的有机反应;此外,较大的内部体积也可以存储多种原子和分子。化学家预测施瓦茨碳将具有独特的电子学、磁性和光学性质,可被用作超级电容器、电池电极和催化剂,并具有适用于气体储存和分离的大型内部空间。
⑤玻璃碳
玻璃碳是一类非石墨型碳单质,其中碳原子为sp²杂化。玻璃碳广泛用作电化学中的电极材料,以及高温坩埚和某些修复装置中的部件。
玻璃碳由英国的一所实验室生产的。科学家在开发一种有着类似钻石结构的聚合物基质时,发现了一种无需催化剂就可以经过特殊处理而凝固的可吸收酚醛树脂。利用这种树脂,玻璃碳就被生产出来。
玻璃碳的制备需在3000°C以下的温度下对有机前体进行一系列热处理。与一般的非石墨碳单质不同,玻璃碳并不透气,在化学上比较惰性。目前已经证明,某些玻璃碳在氧气、二氧化碳或水蒸气中的氧化速率均低于任何其他碳单质。玻璃碳也具有很强的耐酸性。普通石墨会被浓硝酸氧化,但玻璃碳经过几个月也不会受到影响。
⑥原子碳
在某些条件下,碳可以以原子形式存在。原子碳是在非常低的压力下通过大电流形成的。原子碳非常不稳定,但可用于制造某些含卡宾的中间产物。
Ⅰ:单原子碳
单原子碳是一种无色气态物质,化学式C。单原子碳在动力学上不稳定,会发生自发聚合。单原子碳是最简单的碳形式,也可以被认为是石墨的单体。
Ⅱ:双原子碳
双原子碳是一种在高温下以双原子分子形式存在的碳单质,分子式为C₂。双原子碳会在碳蒸气中存在,一般含量约为28%,但双原子碳的含量随着温度和压力的改变也会发生变化。双原子碳可通过电弧制备,同时也会产生C₆₀。在彗星、恒星大气层、星际物质以及烃类的蓝色火焰中也有双原子碳的存在。
Ⅲ:三原子碳
三原子碳是一种无色气体,它仅能作为加合物存在于稀释的溶液中。它是最简单的不饱和卡宾之一。
三原子碳是一个小型碳簇,最早是在彗星尾部进行光谱观察发现的,随后在恒星大气中检测到了存在。三原子碳也可以在星际空间中找到,而在地球上存在的三原子碳是在实验室中进行激光烧蚀生产的。三原子碳也被视为煤烟的前体和在工业上某些富勒烯合成的中间产物。分子几何学通过其特有的对称和振动拉伸模式已确定三原子碳为线性结构,并有着与烯烃相对应的129至130皮米的键长。三原子碳在实验中的电离电位为11-13.5eV。而三碳阳离子的结构却与三原子碳不同,呈现弯曲的状态。三原子碳也被确定为各种含碳物质燃烧反应中的瞬态产物。
⑦碳纳米泡沫
碳纳米泡沫是第五种已知的碳同素异形体。它由一个低密度的碳原子簇组成,其中碳原子采用sp³和sp²的混合杂化方式,这些碳原子被串在一个松散的三维网络中。
每个原子团大约6纳米宽,整体结构由约4000个碳原子组成,这些碳原子以石墨状的薄片连接在一起。碳纳米泡沫有着负曲率,这是因为其结构在规则的六边形结构中夹杂了七边形结构。这与C₆₀的情况正好相反,在C₆₀中,规则的六边形结构中夹杂了五边形结构而得到正曲率。
碳纳米泡沫的结构与气凝胶相似,但其密度仅为先前生产的碳气凝胶密度的1%,仅为海平面空气密度的几倍。但与碳气凝胶不同,碳纳米泡沫是一种不良的导电体。
⑧碳化物衍生碳
碳化物衍生碳是一系列新形碳材料,其中碳原子采用sp³和sp²的混合杂化方式,碳化物衍生碳具有与常见碳单质不同的表面几何形状和碳原子排序。碳化物衍生碳是从金属碳化物前体中选择性地去除金属得到的,常用的金属碳化物有碳化钛、钛碳化铝、碳化钼等。该合成可通过氯处理、水热合成或高温真空下金属选择性解吸来完成。碳化物衍生碳具有高孔隙率和高表面积比,具有可高度调节的孔径,是有着广泛前景的材料。碳化物衍生碳可用于超级电容器储能、水溶液的过滤、电容脱盐、催化剂载体、细胞因子去除等等方面。
⑨蓝丝黛尔石(也称六方金刚石)
蓝丝黛尔石是碳的一种同素异形体,它有着六角形的金刚石结构,由sp³杂化的碳原子构成,被认为是由陨石中的石墨撞击地球形成的。巨大的热量和冲击力将石墨转化为金刚石,但却保留了石墨的六角形晶格。目前在实验室中也通过在静压机中或使用炸药压缩和加热石墨来合成蓝丝黛尔石。蓝丝黛尔石也可通过聚碳炔氢在惰性气体气氛(例如氩气,氮气)下从110度开始逐渐加热至1000度进行热分解合成。蓝丝黛尔石较低的硬度主要原因是其类金刚石结构不完整所致。
⑩直链乙炔碳
直链乙炔碳,也称线性卡拜或线型碳,是碳的一种同素异形体。直链乙炔碳中每个碳都是sp杂化,有着单键和三键交替的结构。直链乙炔碳是很好的纳米材料,它的杨氏模量是已知天然最硬材料金刚石的40倍。目前在星际空间中也观测到直链乙炔碳的身影。
⑪其他可能存在的各种形式的碳同素异形体
Ⅰ:D-碳
D-碳是一种由理论化学家在2018年提出的碳单质。D-碳是正交晶体,每个晶胞6个碳原子,它们以sp³杂化的方式形成。总能量计算表明,D-碳的结构比先前提出的T6结构在能量上处于更有利的状态。
Ⅱ:赵氏碳(也称白碳)
赵氏碳是一种被认为是在陨石撞击中形成的矿物。它被描述为比一种石墨稍硬有着灰色至白色的渐变颜色的物质。赵氏碳的电子衍射图案表明其具有碳炔样的结构,与直链乙炔碳有一定程度的相似。但后来报道称赵氏碳是否存在是有争议的,衍射图中的反射是由粘土杂质引起的。
Ⅲ:金属碳
理论研究表明,在相图中850GPa及7500K以上的条件下,BC8(碳族元素如硅、锗等在高温下形成的亚稳定相态)状态的碳可能具有金属特征。
Ⅳ:体心立方碳
在超过1000GPa的超高压下,金刚石会转变成一种体心立方结构的碳,其晶胞中含有8个碳原子,化学式为C₈。这种体心立方碳可能在天体物理学中具有重要意义。体心立方碳的结构与立方烷相类似,并且也在硅的一个亚稳态相中发现。其他与体心立方碳类似的超硬材料也已有正式合成的记录,而最近碳方钠石也被合成了出来。
Ⅴ:体心四方碳
理论化学家在2010年提出了体心四方碳,它是在室温和超过18.6GPa的高压下由石墨制成的超硬材料。体心四方碳是一种无色透明的新型sp³杂化的碳单质,有着非凡的结构特性和振动特性。体心四方碳的垂直切片结构是六边形的,而平行切片结构是四方形的。
Ⅵ:M-碳
M-碳最早认为是在1963年室温下压缩石墨而产生的。M-碳的结构在2006提出正式的理论构想,并在2009年的实验中观察到。在实验中原本提出了许多结构的碳单质候选物,包括体心立方碳、体心四方碳等等,直到2012年,理论上证明M-碳的这种结构在动力学上最有可能形成。不久之后又出现了高分辨率的分子结构数据,最终表明在所有结构的候选物中只有M-碳与实验结果最为接近。
Ⅶ:Q-碳
Q-碳是一种在2015年发现的铁磁性的碳。快速淬火动力学研究表明,将处于三相点的碳快速转移到标准大气压下可形成超过冷碳,通过高功率纳秒激光脉冲将超过冷状态淬火即可形成Q-碳。Q-碳的质量密度高于无定形碳,并且主要(75%-85%)是sp³杂化的碳原子,其余为sp²杂化的碳原子。预计它具有更好的机械硬度、导电性和一些罕见的碳单质物理特性,包括室温铁磁性和增强磁场发射的能力。估计Q-碳的居里温度约为500K。
Ⅷ:T-碳
T-碳是金刚石中的每个碳原子被碳四面体取代形成的碳单质。T-碳于1985年由理论化学家提出。T-碳产生两个键和一个反键轨道,T-碳会存在奇数的反键相互作用。这种结构也被称为莫比乌斯-3环。
Ⅸ:白矮星碳
有证据表明,白矮星的核心是结晶的碳和氧原子核。BPM 37093是迄今为止在宇宙中发现的含碳晶体最多的白矮星。BPM 37093位于半人马座距地球约53光年,它属于DAV型脉动白矮星,即鲸鱼座ZZ型变星。据推测,BPM 37093内部含有约5×10²⁹千克的碳晶体。科学家认为白矮星内部的温度和压力会导致碳以体心立方晶格的形式构成晶体,其周围还会被费米电子海所包围。
Ⅹ:棱晶碳
棱晶碳是理论预测的亚稳态碳同素异形体,化学式为C₈。棱晶碳是由8个碳原子的原子团簇为基本单元形成的,其形状是由在上下方有两个以上的原子的六原子三角形棱柱延长成的三角形双锥体。
Ⅺ:莱夫斯图碳(也称K₄晶体)
莱夫斯图是一种理论预测的三维晶体亚稳态碳结构,其中每个碳原子以类似石墨的120°角与另外三个碳原子键合,但相邻层的键合面成70.5°的一定角度,而不是重合,这样可以形成具有手征对称性的三维结构。
Ⅻ:五边石墨烯
五边石墨烯是一种碳同素异形体,其完全由五边形的碳结构组成,类似于开罗五边形镶嵌。2014年,科学家根据理论分析与模拟正式提出了五边石墨烯。进一步的计算表明,纯净形式的五边石墨烯并不稳定,但可通过氢化变得更加稳定。由于其原子结构,五边石墨烯具有异常低的泊松比,并且理论上还会有着非常高的理想强度,甚至可以超过普通的石墨烯。
五边石墨烯含有sp²和sp³杂化的碳原子。与普通石墨烯的良好导电性不同,五边石墨烯是一种绝缘体,其间接带隙为4.1-4.3eV。五边石墨烯的氢化形式为五边石墨烷,它具有类似钻石的结构,没有sp²杂化的碳原子,因此它有着比五边石墨烯具更宽的间接带隙(约5.8eV)。科学家目前也已开始研究手性五边石墨烯纳米管,其也可能成为碳的新亚稳态同素异形体。
ⅩⅢ:海克尔碳
海克尔碳是由多种多边形的碳单元结构进行周期性有序排列产生的三维的碳原子网络,它可以是扁平的也可以是管状的。海克尔碳最初由于2000年提出,目前尚未在实验室中合成,但已经成为大量理论工作的主题。
ⅩⅣ:五六七石墨烯
五六七石墨烯是由五元碳环、六元碳环及七元碳环组成的石墨烯同素异形体。五六七石墨烯是在2015年基于系统进化结构探索模拟而提出的。理论研究表明,五六七石墨烯不仅具有动态热稳定性,而且还具有扭曲的狄拉克椎。这些方向相关锥体对外部可调节费米速度的应变有很强的抗变换性。
另一种碳同素异形体海克尔碳同样可由多种多边形组成。科学家早在2000年就提出了海克尔碳三种类型(矩形,倾斜和六边形),海克尔碳相比五六七石墨烯有着更高的能量。另外,相比五六七石墨烯,海克尔碳具有一定的金属特性。
五六七石墨烯预计有着193.2千卡/摩尔的势能。键级为1.33,与石墨烯大致相同。
ⅩⅤ:新星烯
新星烯是由sp³杂化的六方金刚石和一些sp²杂化的碳环共同组成的。由于六方金刚石是绝缘体,而sp²杂化的碳环具有离域的电子可作为导体,因此这些预测材料在晶体管和半导体等电子元件中具有潜在的应用前景。根据分析其结构和电子特性,理论上可以新星烯为基础构建数百种不同的碳同素异形体。
ⅩⅥ:原生烯
原生烯是由六角形的松散碳原子组成。它的晶胞包含48个碳原子。其中有12个碳原子会在sp³和sp²杂化间切换组成,并形成二聚体结构。通过密度泛函理论模拟,科学家最终确定了原生烯的平衡结构,并估计其束缚能比金刚石少2%。此外,科学家还根据X射线衍射图估计了其直接带隙的强度约为3eV。原生烯拥有与氮化镓类似的半导体特性,这使得其能够应用于具有高击穿电压的高频电子组件。
ⅩⅦ:环状碳
环状碳是仅由n个碳原子组成的碳单质,其通过连续的共价键在环中连接。由于该化合物仅由碳原子组成,因此被认为是一种碳的同素异形体。如果n是偶数,则存在两种结构,一种是单键和三键之间交替形成的环状多炔,另一种是全部由双键组成的环状多烯。如果n是奇数,则只存在由双键组成的环状多烯的这一种情况。
理论上最简单的环状碳是环丙三烯,这是一种假想的碳同素异形体,曾被认为是光谱上观察到的三原子碳。
环己三炔也被称为苯三炔,分子式为C₆,这也是一种假想的碳同素异形体。目前已经有科学家开始着手研究合成苯三炔的方法,例如裂解苯六甲酸酐。但截止至2011年,尚未有人合成成功。最近的调查得出的结论称,由于过大的角张力,苯三炔是不可能存在的。一种名为环己六烯的环状累积多烯烃可能是苯三炔的一种亚稳态异构体。
根据理论计算模拟预测热力学稳定的最小环状碳为C₁₈,理论计算的应变能为72千卡/摩尔。
2. 同位素
碳同位素是含有六个质子和多个中子(2-16个)的同位素。碳具有两种稳定的天然存在的同位素,碳-12和碳-13。地球上稳定的碳中98.93%都是碳-12,而碳-13只占剩余的1.07%。在生物中碳-12的浓度会进一步增加,因为生物体中的生化反应会选择性排除碳-13。国际纯粹与应用化学联合会采用碳-12作为相对原子量的基础。利用碳-13可在核磁共振实验中对碳进行鉴定。
碳-14是一种天然存在的放射性同位素,是由高层大气中的氮与宇宙射线发生相互作用产生的。地球仅存在痕量的碳-14,浓度为万亿分之一或更多,主要会存在于大气和一些地表沉积物,如泥炭或其他有机物质。碳-14会进行能量为0.158MeV的β⁻衰变。由于碳-14的半衰期相对较短只有5730年,因此古代岩石中几乎没有碳-14。大气和生物体内碳-14的含量几乎是恒定的,但在死亡后它会开始减少。根据碳-14可以测定高达约40000年的含碳材料的年龄。
碳有15种已知的碳同位素,寿命最短的是碳-8,它会进行质子发射和α衰变,半衰期为1.98739×10⁻²¹秒。碳-19具有核晕效应,这意味着它的半径将明显大于预期核密度半径。
3. 存量
碳在全宇宙各元素中总质量排列第四,位于氢、氦和氧之后。碳大量存在于彗星、大部分行星大气层、太阳以及其他恒星中。一些陨石含有太阳系还处于原行星盘时所遗留下来的微钻石。陨石撞击时的巨大温度和压力也会在撞击坑处形成微钻石。
宇宙中超过20%的碳可能以多环芳烃和复杂碳氢的化合物存在。在多环芳香族烃世界假说中,被认为与生物的形成有很大作用。在大爆炸之后,多环芳烃似乎已形成“几十亿年”,在宇宙中广泛存在,并与新的恒星和系外行星有关。
据估计,地球整体固体土壤碳含量为730ppm,地心为2000ppm,地幔和地壳为120ppm。地球的质量为5.972×10²⁴千克,这意味地下存在着4.36×10¹⁸吨的碳。这远远超过海洋或大气中的碳含量。
碳与氧会结合成二氧化碳,大量存在于地球大气中,还有一些溶解在所有水体中。整个生物圈共含有约1.9万亿吨碳。碳氢化合物同样含有碳:煤矿储备共有约9000亿吨碳,石油储备有约1500亿吨碳,而天然气则有约1050亿吨碳,但仍不包括页岩气等非常规天然气源。碳也封存在地球两极和海底的甲烷水合物中,碳含量估计共有5千亿至2万5千亿吨,另有研究估计含量为3万亿吨。过去的碳氢化合物含量比今天要多。从1751年至2008年有大约3470亿吨碳在化石燃料燃烧过程中以二氧化碳的形式释放到大气层中。
碳酸盐岩石中含有大量的碳。最大的碳矿石来源是煤,占化石燃料的80%。
宇宙射线会在海拔9至15公里的对流层和平流层处产生碳-14。这一反应中,热中子撞击氮-14原子核,形成碳-14原子核及一颗质子。因此,大气二氧化碳中含有1.5%×10⁻¹º的碳-14。
在我们的太阳系中,在小行星带外部的小行星富有更多的碳,但这些小行星尚未被科学家直接采样。理论上,在未来前往这些小行星可进行碳开采,但目前在技术上是不可能的。
4.恒星中的碳形成
简略介绍,详情可以去看我写的专栏cv1863400
质量较大的恒星可以发生三氦过程形成碳原子核。该过程需要三个α粒子几乎同时碰撞,这是因为氦与氢或另一个氦核的进一步核聚变反应的产物分别产生锂-5和铍-8,这两者都非常不稳定并且几乎衰变瞬间变回更小的原子核。三氦过程需要超过1亿K的温度,由于早期宇宙会快速膨胀和冷却,因此在大爆炸期间没有产生显着的碳。
根据目前的物理宇宙学理论,碳会在赫罗图水平分支上的恒星内部形成。当更大质量的恒星在发生超新星死亡时,碳会像尘埃一样被喷散到太空中。这种尘埃会成为下一代恒星系统形成的组成部分。太阳系属于第三代恒星系统,因此地球生物所赖以为生的碳元素,最初也是在巨大恒星的内部合成的。另外,通过碳氮氧循环过程,碳作为聚变反应的催化剂,为恒星提供了绝大部分的能量。
亚毫米波天文学能够探测到含不同碳同位素的一氧化碳间的循环转换(¹²CO、¹³CO、C¹⁸O),这可用于研究分子云中刚刚形成的恒星。
5.碳循环
在地球上并不容易发生元素间的转变,因此地球上的碳基本上是守恒的。任何使用到碳的物理及化学过程都必须从一处取得碳,并在过程后转移到另一处。环境中碳所遵循的路径称为碳循环。植物从周围环境中吸取二氧化碳,用以增加自身质量。动物可能会进食一部分植物体,并再以二氧化碳把碳还原到环境中。整个碳循环实际上复杂得多,比如一些二氧化碳会溶解在海洋中,动植物死亡后也会成为石油或煤,再经焚烧把碳还原到大气中。
碳循环是一种生物地质化学循环,指碳元素在地球上的生物圈、岩石圈、土壤圈、水圈及大气中交换。碳的主要来源有四个,分别是大气、陆上的生物圈、海洋及沉积物。与氮循环和水循环一起,碳循环包含了一系列使地球能持续存在生命的关键过程和事件。碳循环描述了碳元素在地球上的回收和重复利用,包括碳沉淀。
全球碳循环通常分为以下几大储集池的碳相互关联的途径交换:大气、陆地生物圈、海洋、沉积物、地球的内部。
碳储集之间的交流发生是各种化学,物理,地质和生物过程的结果。海洋是包含最大的地球的表面附近的碳的活跃储集池。
从大气中减少二氧化碳有以下方式:植物光合作用、动物食用植物、化石燃料形成、海洋有壳动物制造外壳、雨水结合、钟乳石形成。
而经以下过程二氧化碳会重新回归到大气中:生物呼吸作用、微生物分解作用、化石燃料燃烧、海洋有壳动物死亡、酸雨腐蚀岩石。
二、碳化合物
碳化合物是含碳的化学物质。通常状况下,有机碳化合物比无机碳化合物要多得多。碳与其他元素的键一般都是共价键。碳最重要的特性是其可以连接形成长碳链和环。碳一般是四价的,一般的四价碳化合物比较稳定,但碳有时会在自由基、卡宾、碳离子等短寿命的中间体中出现其他价态。
1. 有机化合物
有机这里只是大概介绍一下,有机本身的内容实在是太多,甚至可以作为一个专门的学科。
碳能够形成串连的碳碳键,形成很长的分子链,这种特性叫做成链。碳-碳键比较稳定。因此,碳可以形成几乎无限种不同的化合物。其实,碳化合物的数量比其他所有元素的化合物加起来还要多。
最简单的有机分子是碳氢化合物。这些化合物以一条碳链为主干,并有氢原子键合在碳链上。链长、支链及官能团等都会影响有机化合物的物理及化学特性。烃中的氢也可以被一些杂原子取代,常见杂原子包括氧,氮,硫,磷和非放射性卤素,以及某些金属。含有金属键的有机化合物称为有机金属化合物。某些原子团会大量在有机化合物中重复出现。这些原子团称为官能团,它可以赋予衍生物一些特定的性质,并可以据此对有机化合物进行系统研究和分类。
几乎所有稳定的有机化合物中的碳都遵循八隅体规则并且都是四价的,这意味着碳原子形成总共四个共价键。
所有生物体中都含有碳,并以碳作为有机化学的基础。碳氢化合物在工业上可用作制冷剂、润滑剂、溶剂、塑料的制造原料、化石燃料等等。
碳与氧和氢结合后,会形成众多必不可少的生物化合物,包括糖、木酯素、甲壳素、醇、脂、酯、类胡萝卜素、萜烯等等。碳与氮结合会形成生物碱,再加上硫后会形成抗生素、氨基酸及橡胶等等。最后加入磷,会形成生命所需的化学编码分子DNA及RNA,以及生物细胞用以传递能量的三磷酸腺苷。
2. 无机化合物
①碳化物
在化学中,碳化物指的是由碳和电负性更低的元素组成的化合物。常见实例有碳化钙、碳化三铁、碳化钨等等。碳化物通常可以通过化学键类型分为如下几类:
Ⅰ:盐类碳化物
盐类碳化物由低电负性元素组成,如碱金属,碱土金属和一些第3族金属等。铝可以形成盐类碳化物,但镓、铟和*不会形成盐类碳化物。常见盐类碳化物可分为以下几类:
甲烷碳化物:
这类碳化物会水解产生甲烷。常见的例子有碳化铝、碳化铍等
过渡金属碳化物不是盐类碳化物,某些过渡金属碳化物虽然也可与水反应,但会非常缓慢且常被忽略。
炔化物:
炔化物是炔类阴离子的盐,其中的碳原子之间含有三键,水解会产生乙炔。碱金属,碱土金属和镧系元素会形成乙炔化物,例如碳化钠、碳化钙和碳化镧(LaC₂)。镧系元素也形成化学式为M₂C₃的碳化物,有时也会被称为炔化物衍生物。第11族的金属也倾向于形成炔化物,如碳化亚铜和碳化银。
镧系元素炔化物的碳碳键长比常见的碱金属或碱土金属炔化物碳碳更长,其中额外的电子会离域进入碳原子的反键轨道。
倍半碳化物(也称烯丙碳化物):
这种碳化物含有C₃⁴⁻离子,水解会产生丙炔和丙二烯。常见的这种类型的化合物有Li₄C₃和Mg₂C₃。这种离子是线性的,与二氧化碳互为等电子体。Mg₂C₃中的碳碳键长为133.2pm。
Ⅱ:共价碳化物
尽管几乎所有碳化物都表现出一些共价特征,但只有一些非金属的碳化物被称为共价碳化物,如碳化硅和碳化硼。碳化硅具有两种相似的晶形,它们都与金刚石结构类似。而碳化硼(B₄C)却具有不寻常的结构,其具有由碳原子连接的二十面体硼单元,与硼化物的结构有一定相似之处。碳化硅和碳化硼都是非常坚硬的耐火材料,在工业上有重要用途。硼也可以形成其他共价碳化物,如B₂₅C。
Ⅲ:间隙碳化物
第4、5和6族过渡金属的碳化物通常被称为间隙碳化物。这些碳化物具有一定金属性质可作为耐火材料。碳化铪与碳化钽的混合物甚至是已知熔点最高的物质。当金属原子半径大于约135pm时,碳原子与紧密堆积的金属晶格中的八面体空隙相符:
当金属原子体心立方密堆积时,碳原子会填充所有八面体空隙,达到1:1的化学计量比。
当金属原子是六方密堆积时,由于八面体空隙在金属原子层的任一侧上彼此直接相对,因此仅用碳填充这些中的一个,达到2:1的化学计量比。
由于碳化物中金属原子晶格的堆积与金属本身的堆积不同,碳原子本身适合对金属晶格的八面体空隙进行密堆积。
Ⅳ:中间过渡金属碳化物
当过渡金属离子小于临界值135pm时,碳化物并不会形成间隙结构,其结构会更加复杂,可能会有多种不常见的化学计比,例如,铁可以形成许多碳化物,包括Fe₃C,Fe₇C₃和Fe₂C等。其中最着名的是渗碳体Fe₃C,它广泛存在于合金中。这些中间过渡金属碳化物比间隙碳化物更具反应性,比如,铬,锰,铁,钴和镍的碳化物都可被稀酸水解,有的甚至能被水水解,并产生烃。相比间隙碳化物,它们与盐类碳化物更加相似。
Ⅴ:分子络合碳化物
含有碳的金属配合物称为金属络合碳化物。最常见的是以碳为中心的八面体簇。
Ⅵ:假想碳化物
某些金属,如铅、锡等,被认为在任何情况下都不会形成碳化物。然而在其他金属原子的帮助下可能形成一些多金属碳化物,曾有报道存在一个混合钛锡的碳化物,这是一种二维的导体。
Ⅶ:相关的其他碳化物
石墨层间化合物:又称石墨插层化合物,是由带正电或负电的离子插入被氧化或还原的石墨层间后形成的具有二维层状结构的化合物。
富勒烯化合物:这是一种含有富勒烯阴离子的化合物。C₆₀和C₇₀最容易形成富勒烯阴离子。这种离子可能存在着多种不同电荷,如[C₆₀]n-(n=1,2...6),并且几乎所有的富勒烯都可以转化为阴离子。最常见的衍生物是含有碱金属的富勒烯化合物,一般都是通过其他有机物制备。
内生富勒烯化合物:将附加的原子或团簇置入富勒烯内部即可形成内生富勒烯化合物。主要分为内生金属富勒烯和内生非金属富勒烯。
金属碳笼碳化物:由碳原子团簇与金属形成的笼状碳化物,这类碳化物的通式为M₈C₁₂,其中M是过渡金属,如钛,锆,钒等。
可调谐纳米多孔碳:也称碳化物衍生碳,是将金属碳化物中的某些金属分子去除得到的高度多孔,纯净的碳材料,能够高密度储存能量。
过渡金属卡宾配合物:可用通式LnM=CR₂表示,它在形式上含有M=C双键。自由状态的卡宾:CR₂由于碳原子的形式氧化态为+2价,碳原子周围只有6个价电子因而异常活泼,寿命极短,它们是许多有机化学反应的中间体,仅有少数几例可以分离得到。虽然卡宾不能直接和金属反应,但卡宾能和金属结合形成配合物而稳定。
二维过渡金属碳化物:也称MXene,是由几个原子层厚度的过渡金属碳化物等结构组成的化合物。它最初于2011年报道,可能有着过渡金属碳化物的金属导电性。
②碳氧化合物
最简单的碳氧化合物是碳氧化物,其中以一氧化碳和二氧化碳是最为常见。
一氧化碳与二氧化碳:
一氧化碳是一种无色,无味的气体,其密度略低于空气。一氧化碳可与血红蛋白会结合成碳氧血红蛋白,阻止氧气的转运造成缺氧。一氧化碳由一个碳原子和一个氧原子组成,通过由两个共价键及一个配位共价键以三键连接。一氧化碳与其他具有十价电子的三重键合双原子分子互为等电子体,如氰离子,亚硝酰离子和氮气分子。工业上有很多合成一氧化碳方法,如鲍多尔德平衡反应,水煤气及碳还原金属氧化物等等。实验室会通过甲酸脱水,锌粉碳酸钙共热,硝酸银和碘仿,草酸盐分解等等反应制取。在配位络合物中,一氧化碳作为的配体被称为羰基。许多金属或金属氧化物会和一氧化碳反应生成金属羰基配合物。它们可以发生羰基取代,某些还原反应及某些亲核试剂反应。硫也可以和碳形成类似的一硫化碳,由二硫化碳放电分解或与低浓度氢气还原可得。
二氧化碳是最常见的碳氧化物,常压下为无色、无味、不助燃、不可燃的温室气体。二氧化碳分子为sp杂化,形成直线构型。植物会进行光合作用消耗二氧化碳,但由于人为排放增加,二氧化碳含量逐年升高。二氧化碳可用于食物防腐、饮料、灭火器等等方面。二氧化碳溶于水会生成碳酸,碳酸可以形成多种盐类,广泛应用于生活与工业中,某些条件下碳酸盐可以多聚形成重碳酸盐或三碳酸盐。其他16族元素也可以与碳形成二元化合物,它们可用作溶剂,多种非金属也可同时与碳形成化合物,如羰基硫。
除了这两种为人熟知的无机物,碳与氧其实还能构成许多稳定或不稳定的碳氧化物,但在现实生活中很难接触到其他碳氧化物,如二氧化三碳、苯六甲酸酐(C₁₂O₉)等。
在1830年发现苯六甲酸酐和1873年发现二氧化三碳后,已有数十种碳氧化物被人们发现,大部分是在20世纪60年代人工合成的。这些碳氧化物有的在室温下是稳定的,有的却即使在超低温环境中也会迅速分解为较简单的其他碳氧化物。一部分寿命极短的亚稳态碳氧化物是作为化学反应的中间体出现而被观测到的,这类碳氧化物的化学性质十分活跃,以至于常常只能在气相中或基质隔离下短暂存在。
新碳氧化物的合成量至今仍有不断上升的趋势。氧化石墨烯以及具有可变结构的稳定碳氧化物聚合物的发现说明在这个领域还有许多未知等待人们探索。
许多只能在极端条件下被探测到的不稳定的或处于亚稳态的碳氧化物包括:一氧化二碳自由基(:C=C=O)、三氧化碳、四氧化碳、五氧化碳、六氧化碳以及1,2-二氧杂环丁烷二酮等。这些活跃的碳氧化物中一部分是利用转动光谱在星际介质内的分子云中发现的。
此外,还有众多未被发现的假想碳氧化物已经从理论途径开始被研究。例如乙二酸酐、乙烯二酮、一氧化碳的线形或环状寡聚物(也称为“聚酮”,(-CO-)n),以及二氧化碳的线形或环状寡聚物【(-CO₂-)n,如等二聚体1,3-二氧杂环丁烷二酮和三聚体1,3,5-三氧杂环己烷三酮等】。
虽然氧元素在含氧化合物中一般只呈固定的负二价,只能通过共价键与最多两个原子相连,且几乎不存在以超过三个相连的氧原子形成的链状化合物,过但碳原子最多能与四个原子相连,以碳链为骨架可以形成众多链状或网状的高分子化合物。因此,碳与氧其实是能构组成许多以碳链为骨架的电中性分子的。这些分子中的碳原子可能呈线型排列或围成脂环或苯环,而氧原子则以形成两个单键、一个双键或相连形成过氧基的形式参与形成化合物。
碳氧化物中有许多是不饱和化合物,例如一氧化二碳等,但这些化合物的化学性质都十分活跃,难以大量合成。碳氧化合物分子得失电子时,其中的氧原子可能会变为一价的-O−或三价的≡O+,而其中的碳原子则会变为三价的≡C−。后二者已在一氧化碳中被发现——-C≡O+。带负电荷的氧原子一般出现在碳氧阴离子中。
线形二氧化多碳:
二氧化多碳是碳氧化物中的一类,这类化合物的通式为CnO₂或O=(C=)nO。这类碳氧化物的共同点是碳原子连成直线形的链,而两个氧原子分别连在碳链的两端。这类碳氧化物的成员包括:
CO₂,二氧化碳。
C₂O₂,极不稳定的乙烯二酮。
C₃O₂,亚稳的二氧化三碳;
C₄O₂,二氧化四碳(1,2,3-丁三烯-1,4-二酮)。
C₅O₂,二氧化五碳,在室温下的溶液中能保持稳定。
这类碳氧化物中一些更高级的成员也已在低压气相和/或低温基质中被痕量地探测到了,尤其是通式中n=7和n=17、19及21的二氧化多碳。
线形一氧化多碳:
一氧化多碳是另一类碳氧化物,它们分子式的通式为CnO或(C=)n=O。这类碳氧化物的第一个成员——CO,可能是唯一一个能在室温下以纯净物的形态存在的。在低温基质中光解直线型二氧化多碳能使这些化合物失去一个羰基,在这种条件下反应可以制备达到可被检测的标准的量的含有偶数个碳原子的一氧化多碳(如C₂O、C₄O、和C₆O等)。通式中直到n=9的直线型一氧化多碳分子都已通过向由氩气稀释的气态二氧化三碳放电合成了。一氧化碳、一氧化二碳、一氧化三碳(C₃O)都在星际空间中检测到了。
当通式中的n是偶数时,这类化合物的分子被认为在其三重态(像累积多烯一样),此状态下的原子都由双键相连,一端的碳原子则拥有一个空轨道——就像在︰C=C=O、︰C=C=C=C=O等一样,通式为︰(C=)n=O;当n是奇数时,其三重态则被认为与乙炔型的、具有极性的状态处于共振中——分子一端的碳原子带有负电荷而另一端的氧原子带有正电荷,如-C≡C-C≡O+、-C≡C-C≡C-C≡O+,通式为-(C≡C-)n/2C≡O+。一氧化碳自己也符合这一规律,所以其优势形态应该是-C≡O+。
环状聚羰基碳氧化物:
碳氧化物中还有一类环状轴烯型的化合物,这类化合物分子式的通式为CnOn或(CO)n。这类碳氧化物可被视为一氧化碳的环状寡聚物或对应的环烷烃全部亚甲基都被羰基取代的化合物。一氧化碳可以被认为是这类碳氧化物的第一个成员。理论研究预示乙烯二酮和环丙三酮是不存在的。接下来的三个成员——C₄O₄、C₅O₅和C₆O₆——理论上是存在的,但都可能不稳定,现在只能痕量地合成。
虽然这类碳氧化物分子几乎都是不稳定或不存在的,但与它们有类似结构的阴离子却都是稳定的,这些阴离子有的在19世纪已被人们发现。这类碳氧阴离子包括:
新的氧化物:
C₁₀O₈:1,4-苯醌四甲酸二酐
C₆O₆:乙烯四甲酸二酐
C₁₂O₁₂或C₆(C₂O₄)₃:三乙二酸苯六酯
C₁₀O₁₀或C₆O₂(C₂O₄)₂:二乙二酸-1,4-苯醌酯
C₈O₈或C₆O₂(CO₃)₂:二碳酸-1,4-苯醌酯
C₉O₉或C₆(CO₃)₃:三碳酸苯六酯
C₂₄O₆:三(3,4-二炔-3-环丁烯-1,2-二酮)
C₃₂O₈:四(3,4-二炔-3-环丁烯-1,2-二酮)
C₄O₆:对二氧杂环己烷四酮或二乙二酸二酐
C₁₂O₆:六羰基三环丁烷并苯
这些碳氧化物的许多类似物已在理论上被研究过,其中的一部分被认为是稳定的,如四羟基-1,2-苯醌、二羟基环丙烯酮、方酸、邻二羟环戊烯三酮、玫瑰红酸的碳酸酯或草酸酯。
碳-氧聚合物:
二氧化三碳在室温下会自发聚合成碳-氧比为3:2的聚合物,该聚合物被认为是由六元环内酯组成的线状长链,以单键或双键链接的碳链作为骨架。物理方法测算出每分子这种聚合物链中平均重复单元数约为5-6,以上得出的数值取决于聚合物形成时的温度。
在5GPa的压强中,一氧化碳可被压缩产生类似的红色的、氧含量较高的聚合物,这种聚合物在标况下处于亚稳态。有研究认为,一氧化碳在形成这种聚合物时发生了歧化反应,在压腔中产生了二氧化碳和二氧化三碳,而二氧化三碳才是形成类似上述聚合物的新聚合物的物质。
除上述两种碳-氧聚合物外,经典氧化石墨及其单层氧化石墨也是碳-氧聚合物,其碳-氧比等于或高于5:1。
二氧化碳在一定情况下也可形成类似的聚合物。
另外,富勒烯也可形成超过20种氧化物,如C₆₀O(2种异构体)、C₆₀O₂(6种异构体)、C₆₀O₃(3种异构体)、C₆₀(O₃)₂、C₆₀OO₃、C₁₂₀O、C₁₂₀O₂、C₁₂₀O₄(4种异构体)、C₇₀O、C₁₄₀O
等等。
③碳氮化合物
Ⅰ:共价网状化合物:包括β-氮化碳(β-C₃N₄)及石墨氮化物(g-C₃N₄),β-氮化碳(β-C₃N₄)是一种超硬的材料,预计比金刚**硬。石墨氮化物则可用作电子元件及催化剂。
Ⅱ:氮杂富勒烯:这是一类杂多烯,其中氮取代了一些碳。实例包括(C₅₉N)₂、C₅₈N₂、C₅₇N₃、C₄₈N₁₂等。
Ⅲ:氰化富勒烯:是由氰基基团连接到富勒烯上形成的化合物,它们具有通式C₆₀(CN)₂n,n为1到9。
Ⅳ:氰及其有关衍生物:包括**、聚合氰、异**、聚合异氰、***、异***、氰酸盐(酯)、异氰酸盐(酯)、雷酸盐(酯)、硫氰酸盐(酯)、异硫氰酸盐(酯)等。
氰在标况下是带杏仁味的无色气体。燃烧时呈桃红色火焰,边缘侧带蓝色。氰溶于水、乙醇、乙醚。氰是一种拟卤素。**会被还原为毒性极强的***。氰在高温下与氢气反应生成氰化氢。与氢氧化钾反应生成***和氰酸钾。氰加热至400°C以上聚合成不溶性的白色固体(CN)x。氰是草酰胺的脱水产物,是草酸衍生的腈。
Ⅴ:氰基烷/烯/炔类
常见的有二氰乙炔、四氰乙烯、四氰甲烷、2,2-二异氰基丙二腈、六氰乙烷、六氰环丙烷、六氰丁二烯等等。
二氰多炔是由交替的单键和三键的碳原子链组成,两侧以氮原子结束。虽然二氰乙炔符合通式,但由于不是聚炔不属于此类物质。常见的二氰多炔有二氰丁二炔(C₆N₂)、二氰己三炔(C₈N₂)、二氰辛四炔(C₁₀N₂)、二氰癸五炔(C₁₂N₂)、C₁₄N₂、C₁₆N₂、C₁₈N₂、C₂₀N₂、C₂₂N₂、等等。
Ⅵ:叠氮烷/烯/炔类
最常见的是四叠氮甲烷,可用于炸药、推进剂和烟火等方面。
Ⅶ:氰基杂环
常见的有五氰吡啶、四氰吡嗪、三氰三嗪(含3种异构)、四氰联二三嗪、二氰四嗪(含2种异构)、六氰联二二咪唑、六氰基六氮杂三亚苯等。
Ⅷ:芳香***
常见的有六氰基苯、八氰基萘、十氰基蒽等。
Ⅸ:其他碳氮化合物
如氰氮烯、偶氮二腈、叠氮腈、1-二叠氮基氨甲酰基-5偶氮四唑、三叠氮化三聚氰、三叠氮庚嗪、三氰基亚胺、二叠氮二氰基乙烯、二氰基重氮甲烷、二氰基卡宾及其四种异构体(氰基异氰基卡宾、二异氰基卡宾、3-氰基-2-氮丙烯环卡宾、3-异氰基-2-氮丙烯环卡宾)、1,3,5-三叠氮-2,4,6-三氰基苯、三氰化氮、二氰基碳二亚胺等等。
其他离子:二氨腈离子、三氰基甲烷阴离子、五氰基乙烷阴离子、五氰基丙烯阴离子、2-二氰基亚甲基-1,1,3,3-四氰基丙烷阴离子、三氰基三聚氰阴离子、三偶氮氰基合庚嗪阴离子、氰化富勒烯阴离子、聚合氰阴离子(如一氰基炔阴离子)等等。
④碳硼完
碳硼完是由硼和碳形成的原子簇化合物,有着多面体结构,构型分为闭合式、巢式、椅式等等;类型可分为单碳、双碳、多碳等等;碳硼完可有硼完和炔烃反应制得。碳硼完可以过渡金属作为配体产生金属碳硼完,也可与有机锂试剂去质子化得到锂衍生物,衍生物可与各种亲电试剂反应。碳硼完的一种衍生物碳硼完酸是超强酸,酸性为硫酸百万倍以上,其可将苯质子化形成可分离的盐,甚至还能在不破坏富勒烯结构的情况下将富勒烯质子化。双(二碳硼完)可用作沉淀剂,某些碳硼完可当做催化剂和应用于某些医学方面。
三、应用
碳是构成生物的基础。除了作为食物和木材外,碳的最大用途是在化石燃料上,如天然气和石油等。石油化学工业利用炼油厂把原油蒸馏成汽油和柴油。纤维素是一种植物制造的碳聚合物,出现在棉花和麻中。植物中的纤维素主要有支撑结构的作用。动物来源的碳聚合物有羊毛、羊绒和丝绸。塑料是人工合成的碳聚合物,一般在分子链中含有固定间隔的氧和氮原子。塑料的制造原料都可以从石油加工而成。
碳及其化合物的应用非常广泛。碳可以和铁形成钢合金。石墨与粘土混合后可制成铅笔芯,用于书写和绘画。
木炭可用于绘画、烧烤、炼铁等等。木材、煤炭和石油都可用作燃料,用以发电或保暖。高质量钻石被用作首饰,而工业用钻石则可在金属或石头上进行钻孔、切割和磨光。化石燃料中的碳氢化合物能加工成塑料。聚酯纤维裂解后形成的碳纤维可以为塑料加固,产生轻盈的复合材料。碳纤维的制造原料为经拉伸过的聚丙烯腈以及其他有机物质,其最终的晶体结构和力学属性取决于初始原料和制作工序。由聚丙烯腈做成的碳纤维结构与细长的石墨丝相似,而经过热处理后,结构就会变成连续的一张薄片。这种纤维的拉伸比强度比钢还要高。
炭黑的应用包括:黑色颜料、印刷墨水、艺术油墨和水彩、碳式复写纸、汽车油漆、墨和激光打印机碳粉。炭黑还可以用作橡胶和塑料的填充剂。活性炭可吸附、过滤物质,其应用范围包括防毒面具、水净化、厨房吸油烟机等,也可从消化系统中吸收毒物或气体作医学治疗。碳在高温下可以进行还原反应,如焦炭可将铁矿石转化为铁金属。钢与碳粉末一起加热后,可以达到表面硬化的作用。碳化硅、碳化钨、碳化硼和碳化钛都是超硬材料,在切割和碾磨时被用作磨料。几乎所有衣料都由碳化合物组成,如人造纺织品和皮革等。
四、安全
纯碳对人类的毒性很低,某些形式的石墨或木炭直接进食。碳可以抵抗化学侵蚀,包括消化道中的酸。因此当进入人体组织后,碳会长时间存留。然而,大量吸入颗粒却会刺激肺部,并造成尘肺等病。这些微粒会在肺部积聚。如果进入身体的含碳物质还有其他的杂质,如有机化合物和重金属等,就有可能会对身体造成额外的伤害。
碳对某些生物却有毒。如,碳纳米微尘对果蝇属是有毒的。
碳在高温下能在空气中剧烈燃烧。大量煤炭在无氧状态下经过数亿年后,首次被挖出时,可能会在接触到空气后自燃。
一氧化碳和***对人有着剧毒。


「艾尔登法环」梅琳娜手办开订 立体手办▪

万代「艾尔登法环」白狼战鬼手办开订 立体手办▪

「夏目友人帐」猫咪老师粘土人开订 立体手办▪

「五等分的新娘∬」中野三玖·白无垢版手办开订 立体手办▪

「海贼王」乌索普Q版手办开订 立体手办▪

良笑社「初音未来」新手办开订 立体手办▪

「黑岩射手DAWN FALL」死亡主宰手办开订 立体手办▪

「盾之勇者成名录」菲洛手办登场 立体手办▪

「魔法少女小圆」美树沙耶香手办开订 立体手办▪

「咒术回战」七海建人粘土人登场 立体手办▪

「五等分的新娘」中野二乃白无垢手办开订 立体手办▪

「为美好的世界献上祝福!」芸芸粘土人开订 立体手办▪

「公主连结 与你重逢」六星可可萝手办开订 立体手办▪


「女神异闻录5」Joker雨宫莲手办开订 立体手办▪

「间谍过家家」约尔・福杰粘土人登场 立体手办▪


「街角魔族 2丁目」吉田优子手办开订 立体手办▪

「火影忍者 疾风传」旗木卡卡西·暗部版粘土人登场 立体手办▪

「佐佐木与宫野」宫野由美粘土人开订 立体手办▪

「盾之勇者成名录」第2季拉芙塔莉雅手办开订 立体手办▪

「咒术回战」两面宿傩Q版坐姿手办开订 立体手办▪

「DATE·A·BULLET」时崎狂三手办开订 立体手办▪

「狂赌之渊××」早乙女芽亚里粘土人开订 立体手办▪

「魔道祖师」魏无羨粘土人开订 立体手办▪

「新·奥特曼」奥特曼手办现已开订 立体手办▪